2024年1月27日,本课题组与华南理工大学张译月课题组联合在Nature Communications上发表题为“Cebp1 and Cebpβ transcriptional axis controls eosinophilopoiesis in zebrafish”的研究论文,用斑马鱼模型揭示了嗜酸性粒细胞的时空发育模式、谱系特征及调控机制。

既往对于嗜酸性粒细胞发育及调控的理解主要来自哺乳动物模型的成体造血:功能性嗜酸性粒细胞由骨髓来源的嗜酸性粒系决定祖细胞(EoP)逐级分化成熟[1]。在本研究中,我们借助造血系统与哺乳动物非常相似的斑马鱼模型,从发育早期到成体解析嗜酸性粒细胞的发育特点及调控机制。 首先,我们鉴定了斑马鱼嗜酸性粒细胞谱系的特异性分子标志物eslec,构建了转基因报告品系Tg(eslec:eGFP)斑马鱼品系,对嗜酸性粒细胞的发育进行整体成像发现,在斑马鱼出生后5天嗜酸性粒细胞开始产生并逐渐增多,且主要分布在肾髓(相当于哺乳类的骨髓)、腹腔液、肠道等组织中,展示了嗜酸性粒细胞的早期时空发育模式。 随后,我们利用单细胞测序技术(ScRNA-Seq)将嗜酸性粒细胞谱系分为祖细胞(EoP)、前体细胞(pre.Eos)及成熟细胞(mat.Eos)三种亚群,解析了嗜酸性粒细胞的谱系特征:EoP具备较为活跃的增殖性;pre.Eos中主要富集了核糖体、蛋白修饰与氧化磷酸化的相关通路,可能与大量合成颗粒蛋白有关;mat.Eos表达更多的免疫相关基因。 紧接着,我们进一步探究了Cebp分子对嗜酸性粒细胞谱系发育的层级调控机制,并比较了Cebp调控粒系造血作用物种之间的保守性和差异性。研究结果揭示了斑马鱼Cebp1-Cebpβ转录调控轴在嗜酸性粒细胞谱系发育中的精细作用机制:Cebp1能够抑制嗜酸性粒细胞的谱系决定,并可能影响前体细胞的分化;Cebpβ通过促进嗜酸性粒细胞的谱系决定及pre.Eos分化。研究还发现,人类C/EBPeP27蛋白与斑马鱼Cebp1的功能类似,能在斑马鱼中抑制嗜酸性粒细胞的发育,斑马鱼Cebp1与人类的C/EBPeP27在调控嗜酸性粒细胞发育方面是保守的。
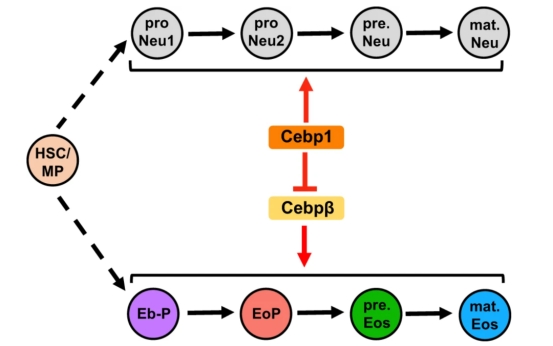
研究内容示意图
综上所述,本研究鉴定了斑马鱼嗜酸性粒细胞特异性分子标志物eslec,并确立谱系特异转基因报告品系,解析了嗜酸性粒细胞的时空发育模式及其谱系阶段性发育特征,发现Cebp1-Cebpβ调控轴在嗜酸性粒细胞谱系发育中的调控机制,并揭示了Cebp1与C/EBPe对脊椎动物粒系造血调控的保守性和差异性。研究揭示了嗜酸性粒细胞的时空发育模式、谱系特征及调控机制。华南理工大学医学院的李高飞博士及在读博士生孙艺聪为该论文的共同第一作者,华南理工大学的张译月教授及本课题组Lai Guan Ng教授为该论文的共同通讯作者。新加坡免疫协作研究所的Florent Ginhoux教授、Immanuel Kwok博士,上海市免疫学研究所的刘兆远研究员,中山大学肿瘤防治中心的贝锦新研究员、何帅博士及彭弯博士等也参与了本研究。该论文受到国家重点研发计划“发育编程与代谢调节”重点研发项目及国家自然科学基金等项目的支持。论文链接:https://www.nature.com/articles/s41467-024-45029-0参考文献:
1. P.C. Fulkerson, Transcription Factors in Eosinophil Development and As Therapeutic Targets, Front. Med. 4 (2017) 1–6. doi:10.3389/fmed.2017.00115.
|